Учёные АГУ и МГУ приблизились к расшифровке «тубулинового кода»
 07.07.2021
07.07.2021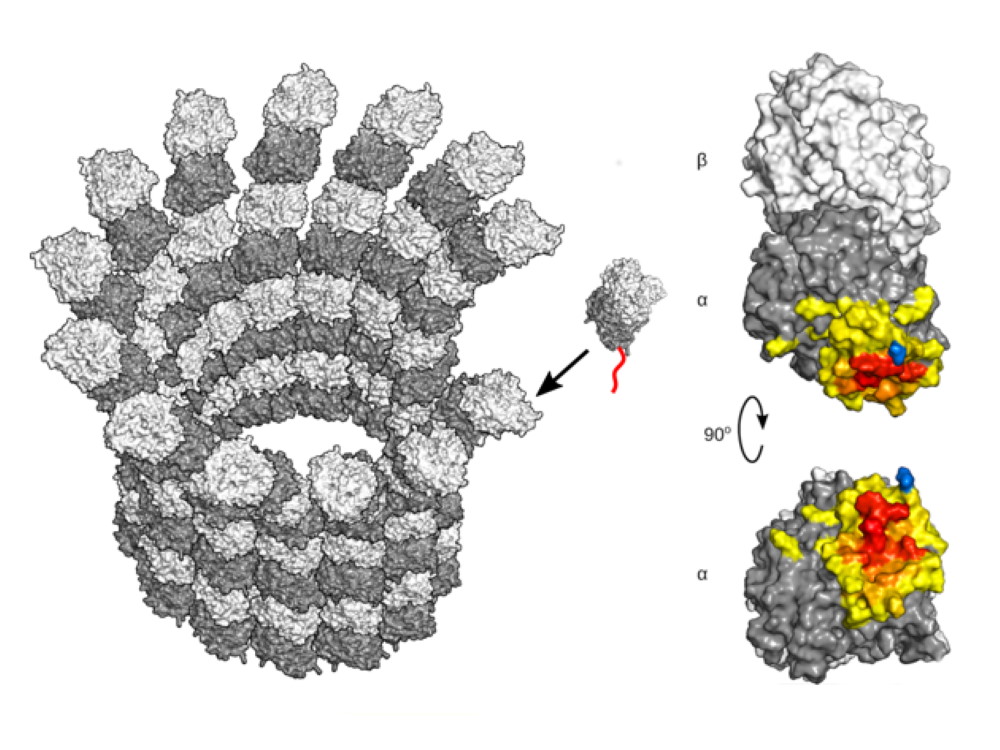
Результаты их исследования были опубликованы в высокорейтинговом журнале Developmental Cell. В состав международного коллектива вошёл доктор физико-математических наук, главный научный сотрудник Лаборатории моделирования экосистем и биоинформатики Физико-математического института Астраханского госуниверситета Илья Борисович Коваленко.
Анализ представленных в статье данных касается новых взглядов на управление сборкой и разборкой белкового скелета клеток с помощью гибких сильнозаряженных полипептидов на концах частей тубулиновых микротрубочек.
«Внутренний скелет клеток высших организмов включает в том числе такой тип белковых структур, как микротрубочки. Они представляют собой длинные цилиндры, собранные из двух похожих белков: α- и β-тубулинов. Тубулиновые микротрубочки обеспечивают жизненно важные процессы в клетке: внутриклеточный транспорт, поддержание формы, внутреннюю организацию органелл, клеточное деление, миграцию, поляризацию, движение жгутиков и ресничек и другие», — рассказывает Илья Борисович Коваленко.
В основе такой многофункциональности микротрубочек лежит явление, называемое «динамической нестабильностью». Оно заключается в способности микротрубочек к спонтанным переходам от стадии медленного удлинения к стадии стремительного укорочения. Динамические свойства микротрубочек, находящихся в разных участках одной и той же клетки, настраиваются по-разному. Для этого специальные ферменты помечают гибкие участки на концах тубулинов (так называемые тубулиновые «хвосты») с помощью специальных модификаций, например, отсоединяя одну или несколько аминокислот от тубулинового «хвоста» или, наоборот, добавляя к нему аминокислоты. Эти модификации получили название «тубулинового кода».
«На сегодняшний день уже многое известно о том, какие изменения динамики микротрубочек записаны „тубулиновым кодом“, но до сих пор почти ничего не известно о том, почему и как это происходит. В частности, до недавнего времени было неясно, меняют ли сами модификации тубулиновых „хвостов“ свойства микротрубочек, или „тубулиновый код“ лишь является опознавательным сигналом для дополнительных белков, которые избирательно влияют на микротрубочки», — поясняет Илья Борисович Коваленко.
Исследователи провели молекулярно-динамические расчёты, которые впервые позволили показать, что гибкие хвосты α-тубулинов могут напрямую влиять на скорость сборки микротрубочек. Это было подтверждено американской частью научного коллектива с помощью экспериментов.
«Результаты наших исследований позволяют предположить, что белки, которые взаимодействуют с тубулинами, способны активировать сборку микротрубочек, связываясь с сильнозаряженным „хвостом“. В статье также впервые показано, что удаление аминокислоты тирозина с конца заряженного хвоста α-тубулина влияет на микротрубочки опосредованно, препятствуя посадке на них дополнительных регуляторных белков», — комментирует Илья Борисович Коваленко.
Полученные данные проясняют механизмы изменения движения микротрубочек, зашифрованные «тубулиновым кодом». Понимание тонкой регуляции свойств микротрубочек поможет при изучении онкологических заболеваний и заболеваний нервной системы, нарушений развития организма, которые связаны с отклонениями динамических свойств микротрубочек от нормы.
.jpg)
На рисунке представлена иллюстрация роли хвостов тубулинов в регуляции сборки микротрубочек. Адаптировано из статьи в журнале Dev Cell
Полностью со статьей α-tubulin tail modifications regulate microtubule stability through selective effector recruitment, not changes in intrinsic polymer dynamics можно ознакомиться по ссылке: https://doi.org/10.1016/j.devcel.2021.05.005.
Метки новости



